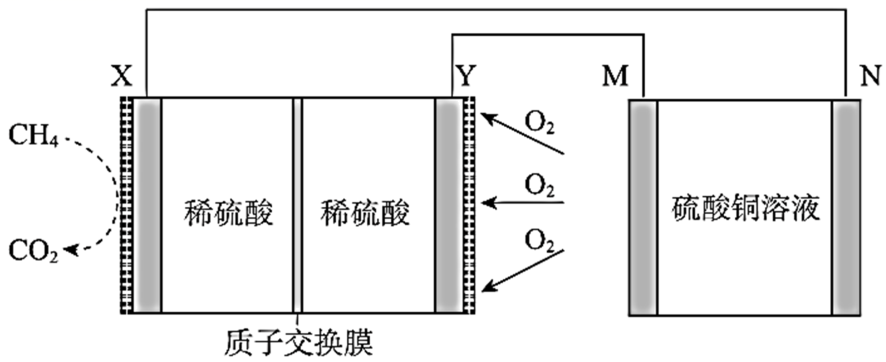
1、甲烷燃料电池在两种不同介质中表现出独特的反应原理在碱性介质中,负极反应为CH4与OH结合释放电子生成CO32和H2O,离子方程为CH4+10OH8e=CO32+7H2O,正极则为氧气与水反应生成OH,总反应为CH4+2O2+2KOH=K2CO3+3H2O这个过程中,随着电池放电,溶液酸性会降低而在酸性介质中,负极CH4。
2、甲烷燃料电池是利用甲烷的氧化反应产生电能的一种装置其基本原理是,甲烷和氧气通过电极反应,将化学能转化为电能解释如下甲烷燃料电池的工作原理 甲烷燃料电池的核心在于其电极反应甲烷作为燃料,在电池的阳极发生氧化反应,而氧气作为氧化剂在阴极发生还原反应在此过程中,电池内部电解质起到传导离。
3、甲烷燃料电池是化学电池中的氧化还原电池燃料电池是燃料和氧化剂一般是氧气在电极附近参与原电池反应的化学电源甲烷CH4燃料电池就是用沼气主要成分为CH4作为燃料的电池,与氧化剂O2反应生成CO2和H2O,反应中得失电子就可产生电流从而发电燃料电池使用气体燃料和氧气直接反应产生电能,其效率高污。
4、甲烷燃料电池的工作原理很简单哦,就像是甲烷和氧气在玩一个“电子传递”的游戏呢具体来说反应物相遇甲烷和氧气在燃料电池里相遇啦电子传递它们俩一见面,就开始发生化学反应,甲烷会“丢”出一些电子给氧气,这个过程就像是小朋友们在玩传球游戏,电子就是他们传递的小球生成产物在这个过程。
5、甲烷的氧化与氧气的还原相互作用,生成水和二氧化碳与直接燃烧甲烷相比,燃料电池的能量利用率通常更高对于负极反应,我们可以从总反应中减去正极反应,得到CH4 + 10OH 8e == CO32 + 7H2O而正极的反应是O2 + 4e + 2H2O == 4OH,两者结合就完整描述了整个电池的工作原理。
6、甲烷燃料电池通常采用碱性电解质,其工作原理可由以下两个电极反应式描述负极反应CH4 + 10OH 8e = CO32 + 7H2O 正极反应O2 + 4H2O + 8e = 8OH 总反应为CH4 + 2O2 = CO2 + 2H2O,进一步与碱性环境结合,生成的CO2会与OH反应得到CO32和H2O,总的反应式可以简化为。
7、CH4 + 2O2 CO2 + 2H2O 这个方程式表示甲烷与氧气反应产生二氧化碳和水,同时释放能量水的生成在甲烷燃料电池中,水是一个重要的产物水的生成方程式如下2H2 + O2 2H2O 这个方程式表示氢气与氧气反应生成水电化学反应在甲烷燃料电池中,电化学反应是电能的产生过程对于固体氧化物。
8、甲烷CH#8324燃料电池,以沼气为主要燃料,通过与氧化剂O#8322反应生成CO#8322和H#8322O,从而产生电流发电在负极,CH#8324+10OH#8315+8e#8315=CO#8323#178#8315+7H#8322O在正极,2O#8322+4H#8322O+8e#8315=8OH#8315这种电池效率高。
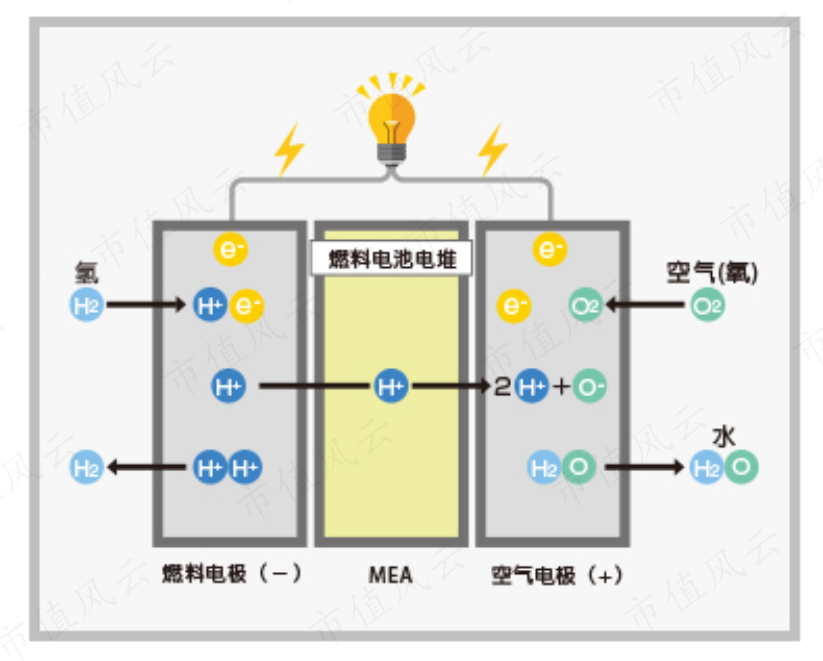
9、阐述燃料电池的工作原理如下1燃料供应燃料电池的燃料,如氢气H2或甲烷旅简CH4,从外部通过管道或气罐进入燃料电池2燃料氧化在燃料电池的阳极正极,燃料分子与氧气分子从空气获取发生氧化反应,产生电子和离子即质子这个过程释放出大量的能量,同时产生一些热量3电荷。
10、燃料电池是一种电化学发电装置,通过燃料与氧化剂的化学反应直接将化学能转化为电能由于燃料电池不需要经过热机过程,因此不受卡诺循环限制,具有较高的能量转换效率燃料电池的工作原理是将燃料和氧化剂分别引入燃料电池的正负极,在电堆的作用下形成回路,从而产生电流燃料电池的优点在于发电效率高。
11、甲烷燃料电池是化学电池中的氧化还原电池燃料电池是燃料和氧化剂一般是氧气在电极附近参与原电池反应的化学电源甲烷CH4燃料电池就是用沼气CH4作为燃料的电池,与氧化剂O2反应生成CO2和H2O反应中得失电子就可产生电流从而发电美国科学家设计出以甲烷等碳氢化合物为燃料的新型电池,其成本大大。
12、甲烷燃料电池是一种将化学能直接转化为电能的装置,在碱性电解质下,负极的电极反应方程式为甲烷与氢氧化钠溶液反应生成碳酸钠和水正极的电极反应方程式为氧气水与电子反应生成氢氧根离子在酸性电解质下,总反应方程式为甲烷与氧气反应生成二氧化碳和水正极的电极反应方程式为氧气与氢离子反应。
13、燃料电池是由化学能转变为电能的,正极发生还原反应,负极发生氧化反应原理同原电池,所以还原性的物质在负极被氧化失电子,氧化性的物质在正极被还原得电子,例如H2O2燃料电池铂做电极 ,电解质溶液为KOH ,正极反应 O2+2H2O+4e=4OH负极反应2H2+4OH 4e=4H2O 铂做电极 ,电解质。
14、我来回答这题有个前提,就是该燃料电池所用电解液是碱液如NaOH溶液18个电子从谁来的CH4中C的化合价是4价,到产物CO32,化合价变成+4价,所以每个甲烷分子参加反应,转移10个电子10个OH是电解液中提供的一部分与产生的CO2反应变成 CO32和H2O燃料电池不是燃烧,是利用燃料。
15、总反应CH4+2O2+2OH=CO32+3H2O 正极O2+4e+2H2O=4OHˉ负极CH48e+10OHˉ=CO32ˉ碳酸根+7H2O。
16、酸性和碱性甲醇燃料电池的工作原理遵循一定的规律酸性环境中,正极反应为8H++2O2+8e=4H2O,负极反应为CH4+2H2O=CO2+8H++8e,总反应式为CH4+2O2=CO2+2H2O在碱性环境下,正极反应为4H2O+2O2+8e=8OH,负极反应为CH4+8OH=CO2+6H2O+8e,总反应式同样为CH4+2O2=。
转载请注明来自浙江华友钴业股份有限公司,本文标题:《甲烷燃料电池工作原理》

 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号
还没有评论,来说两句吧...